bulk转录组联合单细胞转录组免疫相关分析发8分+SCI_转录组测序结果怎么分析
目录:
1.bulk转录组是什么意思
2.转录组蛋白组联合分析
3.转录组unigene
4.转录组kegg
5.转录组fpkm
6.转录组结果不一致
7.转录组wgcna
8.转录组 蛋白组
9.bulk转录组测序
10.转录组结果解读
1.bulk转录组是什么意思
大家好!今天给大家介绍一篇2022年发表在Frontiers in Immunology (IF:8.786)上的一篇文章作者鉴定肝癌免疫亚型并基于免疫细胞丰度构建预测无病生存期和复发的模型Identification of the Immune Subtype of Hepatocellular Carcinoma for the Prediction of Disease-Free Survival Time and Prevention of Recurrence by Integrated Analysis of Bulk- and Single-Cell RNA Sequencing Data。
2.转录组蛋白组联合分析
基于bulk转录组数据和单细胞转录组数据鉴定肝癌免疫亚型并预测无病生存期和复发摘要背景:影响肝癌患者预后的主要因素为复发和转移,然而预测无病生存期(DFS)和复发的方法仍然十分有限方法:本研究使用ssGSEA分析HCC样本中免疫细胞丰度并使用LASSO,单因素和多因素Cox分析评估免疫细胞预测DFS的价值。
3.转录组unigene
随后,使用具有预后价值的免疫细胞构建风险打分模型使用scRNA数据和CellMiner鉴定具有预后作用的免疫细胞与特定靶点之间的相互作用结果:基于三种免疫细胞(效应记忆CD8 T细胞,调节性T细胞和滤泡辅助T细胞构建一种新型高效T细胞风险打分模型(TCRS),可以鉴定DFS较长和具有炎症免疫特征的HCC患者。
4.转录组kegg
随后,作者分析TCRS高打分组和TCRS低打分组的功能差异和免疫细胞间的细胞-细胞交流最终,作者鉴定到15个核心基因可以作为预测HCC患者发生和复发潜在治疗靶点结论:作者构建准确预测HCC患者的DFS模型并进行验证。
5.转录组fpkm
此外,鉴定15个核心基因可以作为预测HCC发生和复发的候选基因流程图

6.转录组结果不一致
结果1. 数据集的获取和下载从TCGA数据库获取371例HCC患者的bulk转录组数据集,从NODE数据库获取159例患者的bulk转录组数据集,从GEO数据库获取242例患者的bulk转录组数据集(GSE14520)。
7.转录组wgcna
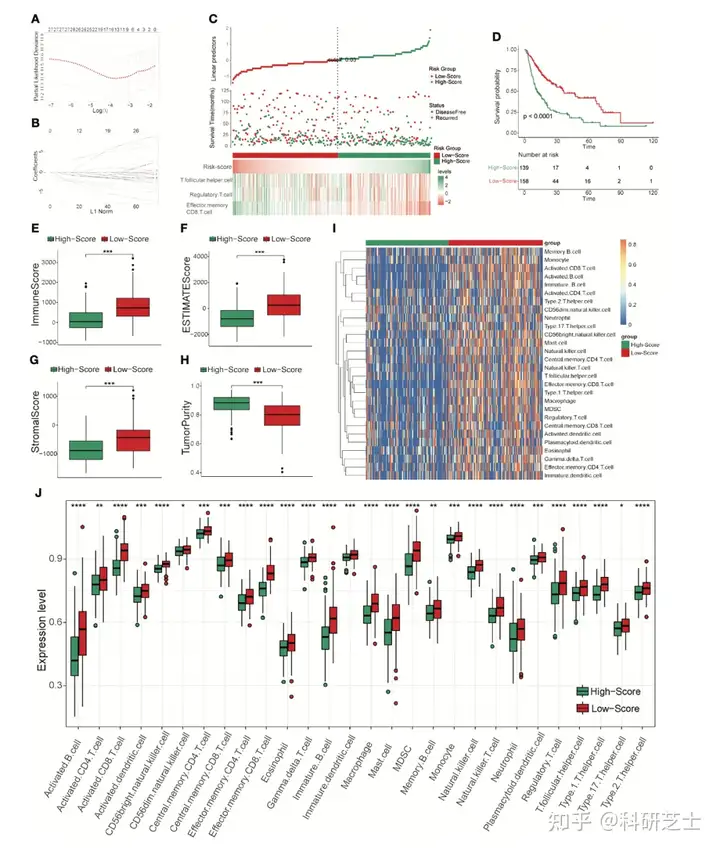
2. 构建和评估TCRS作者使用LASSO分析,单因素Cox分析和多因素Cox分析构建TCRS模型(图1A和1B,表1)TCRS-高打分组,TCRS-低打分组,DFS状态,效应记忆CD8 T细胞,调节性T细胞和滤泡辅助T细胞的丰度如图1C所示。
8.转录组 蛋白组
KM分析表明,TCRS-低打分组的DFS高于TCRS-高打分组(图1C和1D)TCRS-低打分组的免疫打分,间质打分和ESTIMATE打分高于TCRS-高打分组(图1E-1G),而TCRS-高打分组的肿瘤纯度较高(图1H)。
9.bulk转录组测序
此外,TCRS-低打分组的28种免疫细胞的表达水平较高(图1I和1J)以上结果表明,TCRS-低打分组是一种具有较长DFS时间和炎症免疫特征的HCC免疫亚型
10.转录组结果解读
图1 使用训练集构建TCRS模型
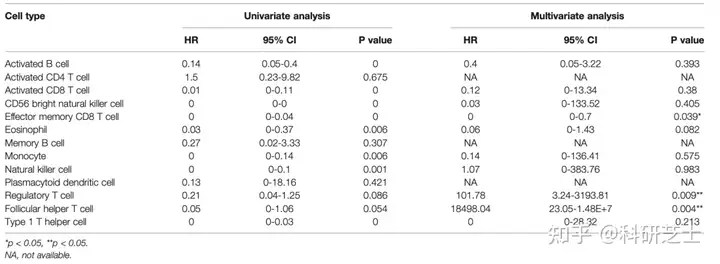
表1 13种免疫细胞的单因素和多因素Cox分析3. TCRS有效性的验证为了进一步验证TCRS模型的有效性,作者使用两个验证集进行验证根据TCRS打分的阈值将两个验证集的HCC患者分别分为高打分组和低打分组。
两个验证集高打分组和低打分组的分组信息,DFS状态,效应记忆CD8 T细胞,调节性T细胞,滤泡辅助性T细胞的丰度如图2A所示KM分析表明,TCRS-低打分组的DFS较长(图2B)TCRS-低打分组的免疫打分,基质打分和ESTIMATE打分较高(图2C-2E),而TCRS-高打分组的肿瘤纯度较高(图2F)。
此外,TCRS-低打分组中的28种免疫细胞的表达水平较高(图2G和2H)
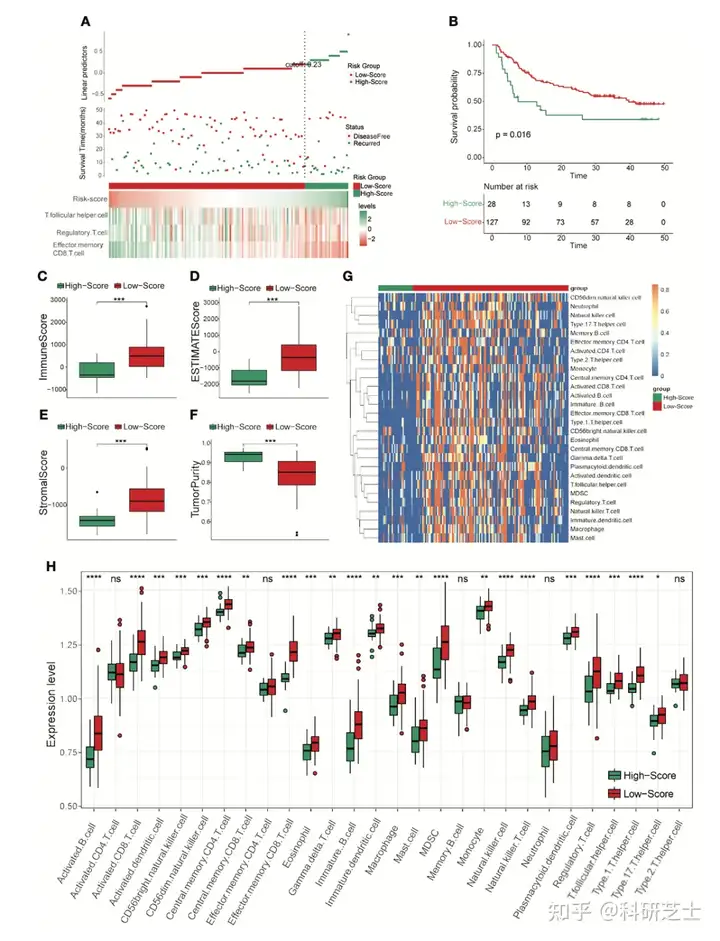
图2 TCRS模型有效性的验证4. TCRS分组的差异分析为了鉴定TCRS-低打分组和TCRS-高打分组的差异,作者进行了GSVA分析差异最显著的10个功能主要为与免疫相关的功能(图3A)两组的差异表达基因如图3B所示并选择显著差异的DEG进行GO和KEGG分析。
GO分析表明富集程度最显著的功能包括淋巴细胞介导免疫,免疫球蛋白复合物和抗原结合等(图3C)KEGG分析表明富集程度最显著的通路包括细胞因子-细胞因子受体互作等(图3D)
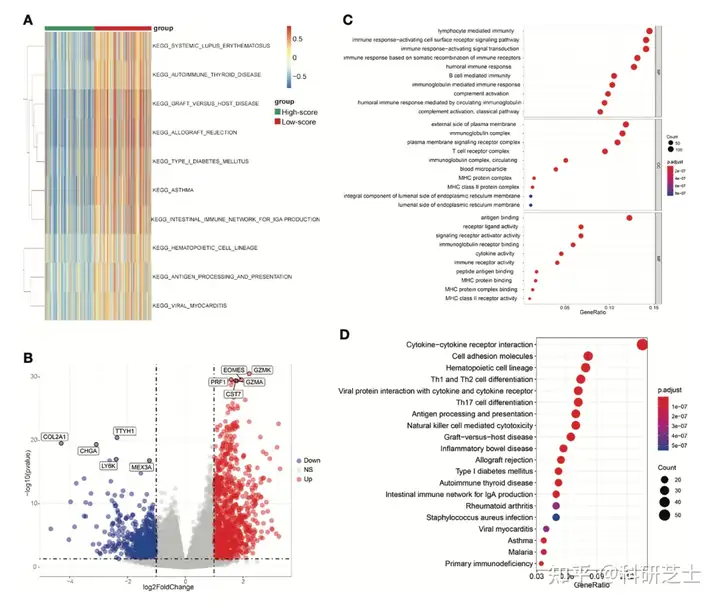
图3 TCRS亚组的差异分析5. 使用HCC患者的scRNA数据鉴定预防复发的特异性靶点为了评估三种预后免疫细胞在HCC复发中的作用,作者对scRNA数据进行分析由于构建TCRS模型的免疫细胞均为T细胞,因此作者对T细胞的单细胞转录组数据集进行分析。
UMAP分析共聚为15个T细胞簇(图4A和4B)随后,作者根据特异性标记对这些T细胞簇进行注释(图4C-4E)并用小提琴图可视化每种细胞簇的特异性基因(图4F)不同T细胞簇在各个样本和不同肿瘤类型中的比例如图4G所示。
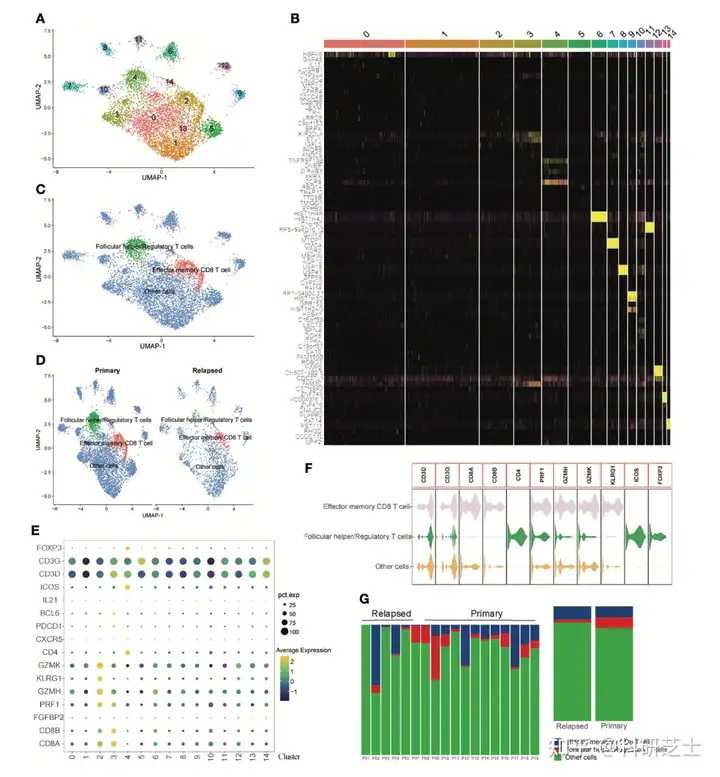
图4 T细胞单细胞转录组数据的可视化为了进一步阐明这些免疫细胞的交互作用,作者进行细胞-细胞通讯分析这些细胞类型间的互作作用如图5A和5B所示接下来,作者进一步研究细胞间潜在的传入和传出信号如图5C所示,效应记忆CD8 T细胞主要是信号提供者,滤泡辅助/调节性T细胞是信号受体。
这些结果表明,这三种细胞类型间最强的交流是效应记忆CD8 T细胞通过GZMA-F2R与自身交流信号通路和效应记忆CD8 T细胞或其他细胞通过CCL5-CCR4信号通路与滤泡辅助性T细胞/调节性T细胞间的互作(图5D和5E)。
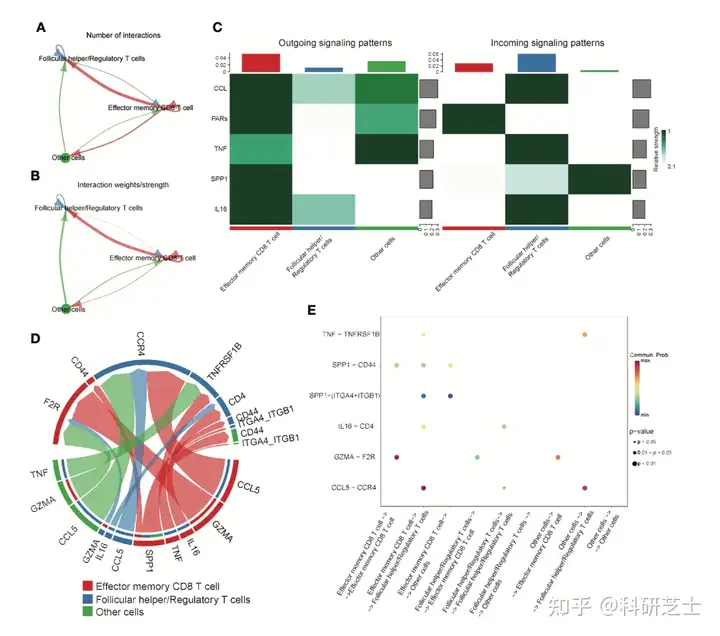
图5 细胞-细胞通讯分析6. 鉴定预防复发的特异性靶点为了进一步筛选预后免疫细胞中与HCC复发有关的核心基因,作者使用scRNA数据鉴定原发性HCC和复发性HCC中的DEGs结果表明,效应记忆CD8 T细胞和滤泡辅助/调节性T细胞中分别鉴定到298和407个DEGs,两组DEGs取合集共有645个DEGs。
随后,作者进行Cox和LASSO分析(图6A和6B),共得到15个预后基因这些基因大部分在TCRS-高打分组中高表达根据这15个预后基因的表达基因和系数构建GRS模型,并根据阈值将患者分为高打分组和低打分组(图6C)。
KM分析表明,低打分组的DFS较长(图6C和6D)此外,免疫分析表明GRS-低打分组的免疫打分,基质打分和ESTIMATE打分较高,而GRS-高打分组的肿瘤纯度较高(图6E-6J)这些结果表明,这15个预后基因可能与免疫细胞影响DFS有关,可以作为预防HCC复发的潜在靶点。
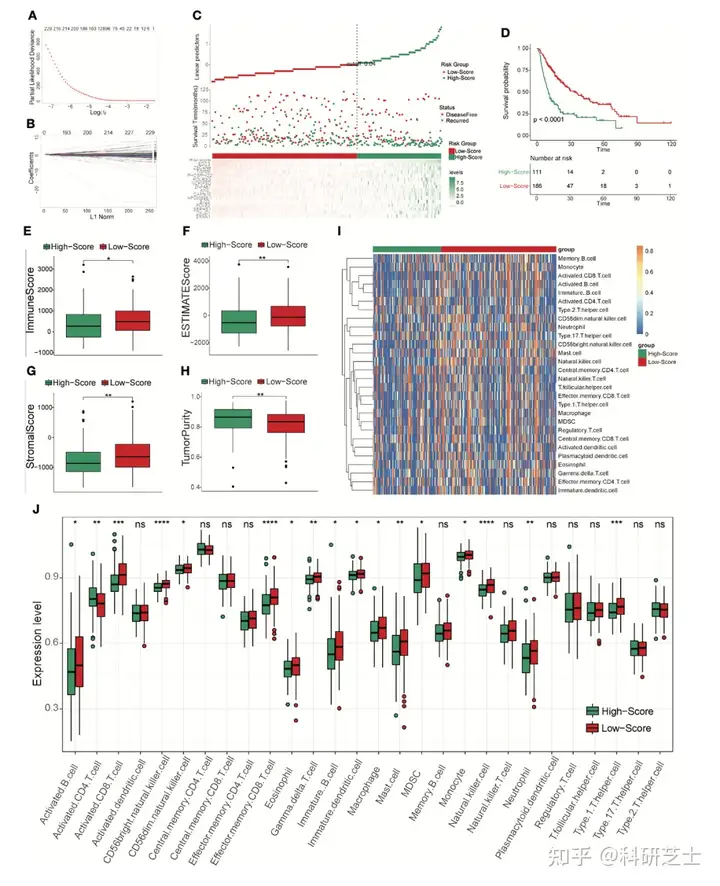
图6 构建并评估GRS模型最后,作者使用CellMiner筛选潜在的预防复发的药物作者比较了核心基因表达水平和药物的IC50值,图7为12对最显著的相关对这些结果表明,这些药物可能通过靶向这15个基因有效的预防HCC复发。
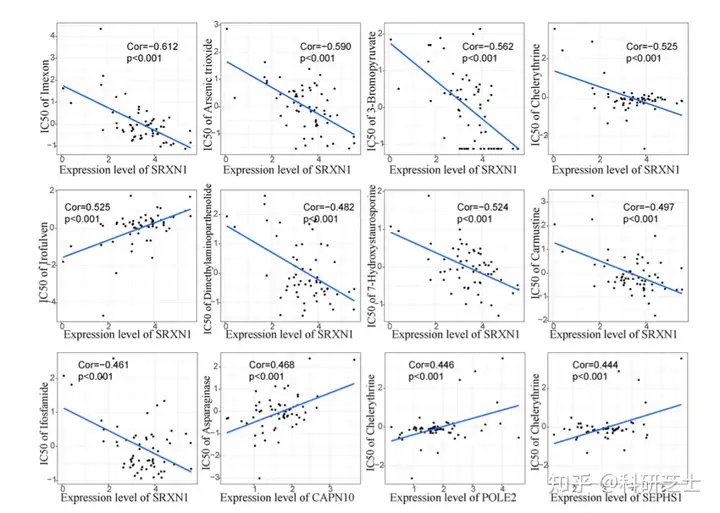
图7 预后基因与潜在靶向药物的相关性分析结论在本研究中,作者基于免疫细胞丰度构建TCRS模型,可以用于预测DFS时间和复发,以及具有炎症免疫特征的HCC患者的免疫亚型随后,作者使用单细胞转录组数据阐明TCRS亚组的功能差异和细胞-细胞间通讯信息,并鉴定到15个关键基因可以作为预防HCC复发的潜在治疗靶点。
本研究的局限性在于缺乏进一步的实验和临床研究证实这15个基因的作用
以上就是关于《bulk转录组联合单细胞转录组免疫相关分析发8分+SCI_转录组测序结果怎么分析》的全部内容,本文网址:https://www.7ca.cn/baike/11799.shtml,如对您有帮助可以分享给好友,谢谢。
